オープンサンドイッチ法
抗体は我々の身体を外敵(抗原)から守る上で中心的な役割を果たす分子である。抗体はタンパク質から低分子までほとんどあらゆる抗原を認識できることから、基礎研究における特異的認識素子としての利用から病院や検査所における臨床診断、さらには最近では難癒疾患の治療にまで幅広い用途がある。抗体を用いる測定法(免疫測定、臨床診断への応用はその一つ)に限っても、その用途は拡大の一途をたどっており、最近では環境汚染物質の簡便な測定法としても注目されている。
通常のたんぱく質は、ほとんどの場合サンドイッチ法と呼ばれる2種類の抗体を使う方法で測定されている。サンドイッチ法は、抗原に同時に結合できる2種類の抗体を用意する必要があるが、その高い特異性と感度から好んで使われている。また分子量1,000以下の低分子(化合物やペプチド)は小さすぎて二種類の抗体でサンドイッチすることができないため低分子は通常競合法と呼ばれる方法で測定される。しかし競合法は、条件設定が難しく、感度が出にくい、測定操作にかなりの注意深さが必要、といった難点も持っている。
このような欠点のない、低分子でも非競合的に測定できる方法として、私たちは以下に示す「オープンサンドイッチ法(OS法)」という免疫測定法を考案した (Fig. 1)。
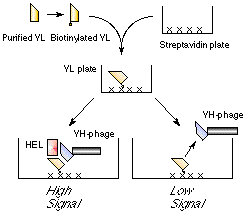
Fig. 1 オープンサンドイッチELISA
この方法は、「抗体の可変領域(抗原結合部位, Fv)は抗原がないと不安定だが、抗原が結合すると安定化される」という現象を利用している。抗体はH鎖とL鎖の2本の鎖で構成されるが、それぞれの抗原結合部位は VH, VLと呼ばれこれらが抗原を認識できる最小単位である可変領域Fvを構成する。最近ではファージ提示法などを用いて容易にVHとVLをコードする遺伝子断片をクローニングすることができるが、VHとVLの間の結合は非共有的で多くの場合不安定であり、これらをペプチドで結んで一本鎖抗体(scFv)として使われる場合がほとんどである。我々はこの不安定な Fvが、抗原が結合すると安定化する場合があり、それを利用すれば抗原濃度を従来より簡便かつ迅速に、さらに感度よく測定できることを見い出した。すなわち上の図の様にVL断片をプレートに固定化しておき、これにVH断片にファージあるいはアルカリフォスファターゼを結合させたものと抗原(この場合鶏卵白リゾチーム)を含むサンプルとを混ぜて一回洗浄した後にプレートに固定化されたファージあるいは酵素の量を測定すれば、これが抗原量と非常によい相関を示すことを見いだした [1]。
この原理を利用すると、サンドイッチ法では2回必要なサンプルとの反応が3者複合体が安定なため1回ですむほか、例えば下図の様にVH断片とVL断片を別々の蛍光色素でラベルすると、両者が近付いたことを蛍光スペクトル変化として溶液中で検出することができる(蛍光共鳴エネルギー移動現象,Fig. 2)。この方法だと、抗原とのインキュベーション後1〜2分で抗原濃度を洗浄操作なしに決定できる。また細胞内での抗原検出にも応用可能である。
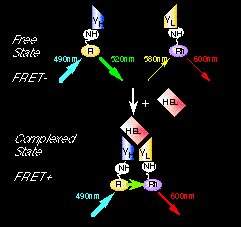
Fig. 2 Open Sandwich FIA
また、両断片間の相互作用を酵素の活性相補を利用して高感度に測定することで平衡解離定数 Kd値の1/1000近い濃度の小分子ハプテン測定がホモジニアス系で可能なことも示されている [2]。競合法では理論的にKd値の1/100が検出限界と言われているので、OS法の非競合法ならではの特徴が発揮されたと言えるであろう。
さらに最近、我々は手持ちの抗体がOS法に向いているか向いていないかが、手軽に調べられる方法を開発した [3-5]。市販のファージ抗体システムに良く似たこの方法(split Fvシステム)を用いれば、手持ちのハイブリドーマの抗体可変領域の抗原結合能とVH/VL相互作用の強弱の両方を、ファージを作る大腸菌を変えることで手軽に調べることができ、またより良い性質の抗体の選択ができる。条件検討が今までより飛躍的に簡単になり、すでに環境ホルモン様作用が疑われるBisphenol A認識抗体をはじめとする多数の小分子認識抗体で、OS法に適した抗体のスクリーニングに成功している。また最近,split Fvシステムよりも更に安定で使いやすいFab提示システム(pDong system)の開発に成功し,多くの抗体スクリーニングさらにはライブラリ選択で良い結果を得ている[6, 7]。
ほとんどの低分子認識抗体はVH/VL両者の界面からなるポケットで抗原を認識していることが知られている。そのため低分子に対して高い親和性を持つFvは抗原結合によりVH/VL/抗原複合体が安定化すると考えられ,実際そのような報告も多い。もしそうであれば低分子の高感度な検出原理として,本法の適用範囲は極めて広いであろう。事実,最近我々は蛋白質のチロシンリン酸化[8], セリンリン酸化[9],カビ毒ゼアラレノン[10],骨疾患マーカーペプチド[11],糖質ステロイド[12],さらには甲状腺ホルモン[7]を非競合的に応答性良く検出することに成功した。競合法に比べ高感度で幅広い濃度範囲の測定が可能な本法が,多くの抗原抗体系でより手軽に実施できるよう,現在更なる技術開発を進めている。また技術指導・共同研究等も積極的に行っており,ご興味いただいた方は是非ご連絡いただきたい。
PS. 更に我々は最近,このOS法に密接な関連を持つ蛍光免疫測定原理を見出し,これに基づく測定素子 “Quenchbody” の開発を進めている。
参考文献
[1] Ueda, H. et al. Nature Biotechnol. 14, 1714-1718(1996)
[2] Ueda, H. J. Biosci. Bioeng. 94(6), 614-619 (2002)
[3] Aburatani, T. et al. Anal. Chem. 75, 4057-4064 (2003)
[4] 上田 宏. 生化学, 76(7), 670-674 (2004)
[5] 上田 宏. 薬学雑誌 127(1) 71-80 (2007)
[6] Dong., J.H. et al. Anal. Biochem. 386, 36-44 (2009)
[7] Islam, K.N. et al. Anal. Chem. 83, 1008-1014 (2011)
[8] Sasajima Y. et al. Biotechnol. Prog. 22, 968-973 (2006)
[9] 大室(松山) 有紀,北岡 優一,上田 宏「細胞周期フロンティア」pp. 11-17, 共立出版 (2010)
[10] Suzuki T. et al. Anal. Sci. 23, 65-70 (2007)
[11] Lim, S-.L., et al. Anal. Chem.,79(16), 6193-6200 (2007);
Ihara, M. et al. Lab. Chip. 10, 92-100 (2010)
[12] Ihara, M. Suzuki, T. et al. Anal. Chem. 81, 8298-8304 (2009)